国际交流
Molecular Psychiatry︱北大六院司天梅团队揭示早年逆境诱发青春期个体认知损害的新机制
为什么精神疾病多在青少年发病?最新的一篇元分析显示,早年不良生活经历使儿童青少年罹患抑郁症的风险增加2.5倍,这可能是青少年精神疾病高发的原因之一。然而,其背后的机制仍是未解之谜。认知损害作为多种精神疾病,如抑郁症的核心症状,常在有早年应激经历的青少年个体出现,然而目前一线的治疗手段不能有效改善这些患者的认知症状,使得认知损害成为目前精神疾病重要的未被满足的临床治疗需求。因此,探索青少年患者认知功能损害的病理机制,并寻求针对这一靶症状更有效的治疗手段是当今精神疾病治疗领域的重要研究方向之一。
近年来,研究发现前额叶皮层(Prefrontal cortex, PFC)中的中间神经元,特别是表达小清蛋白的中间神经元(Parvalbumin interneuron,PVI),在调节神经网络活动和认知功能方面具有重要意义。PVI能够通过抑制性突触传递调控锥体神经元(Pyramidal neuron,PN)的活动,进而影响大脑皮层的信息处理和整合。然而,关于早年应激怎样以及如何影响 PFC 中 PVIs的功能,以及这种改变与青少年个体认知损害之间的因果关系如何,仍不清楚。
近日,我院司天梅教授团队在Molecular Psychiatry上发表了题为“Prefrontal parvalbumin interneurons mediate CRHR1-dependent early-life stress-induced cognitive deficits in adolescent male mice”的研究论文。该研究首次揭示了前额叶PV中间神经元在早期应激诱导的青春期雄性小鼠认知损害中的重要参与作用,为深入理解早年应激相关神经精神疾病的发病机制及开发早期干预策略提供了新的方向。

早年应激(Early-life stress, ES)对认知功能有负面影响且与PFC相关,但具体神经机制不明,尤其是PV中间神经元在其中的角色未知。由此提出问题:PFC中的PV中间神经元是否参与ES诱导的认知损害?结合课题组前期研究发现,研究者推测PFC中的PV中间神经元可能在ES诱导的认知损害中发挥关键作用,且可能与促肾上腺皮质激素释放激素(Corticotropin-releasing hormone, CRH)及其1型受体( CRHR1)信号通路有关。
首先,研究者借助课题组成熟的限制性筑窝材料与垫料早年应激模型。在行为层面上,发现早年应激显著破坏青春期雄性小鼠的认知功能(图1),表明早年应激所致个体认知损害早在青春期既已出现。
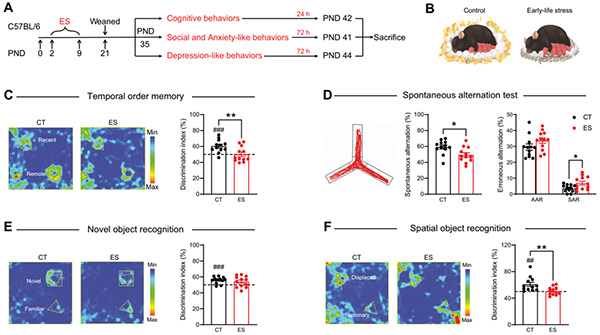
图1 早年应激破坏青春期雄性小鼠的认知功能
随后,研究者通过即早基因c-fos标记结合电生理学技术,观察到早年应激抑制青春期雄性小鼠mPFC的PVIs的兴奋性。并进一步通过光遗传学结合电生理技术,发现早年应激下调mPFC PVIs的活动与降低局部PN神经元的兴奋性输入有关(图2)。
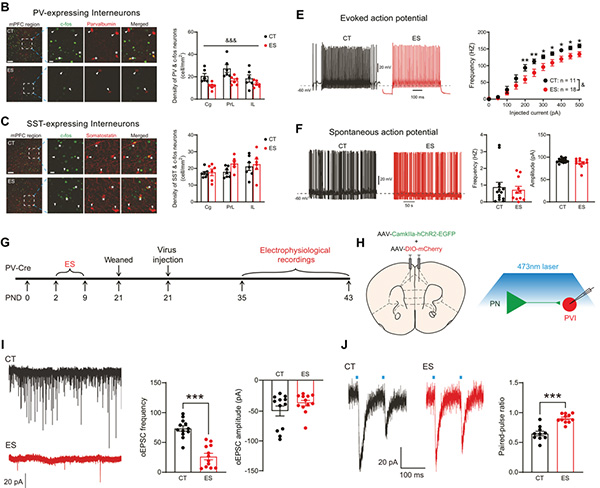
图2 早年应激抑制内侧前额叶PV中间神经元的兴奋性
其次,为阐明mPFC PVIs在早年应激所致青春期小鼠认知损伤中的参与作用,研究者通过光/化学遗传学技术操控内侧前额叶PVIs,结果发现抑制PVIs能够模拟早年应激所致认知损伤;而激活PVIs则能够逆转早年应激所引起的青春期小鼠认知损伤(图3)。这有力地证明了 PFC 中 PVIs功能异常与ES诱导的认知损伤密切相关。
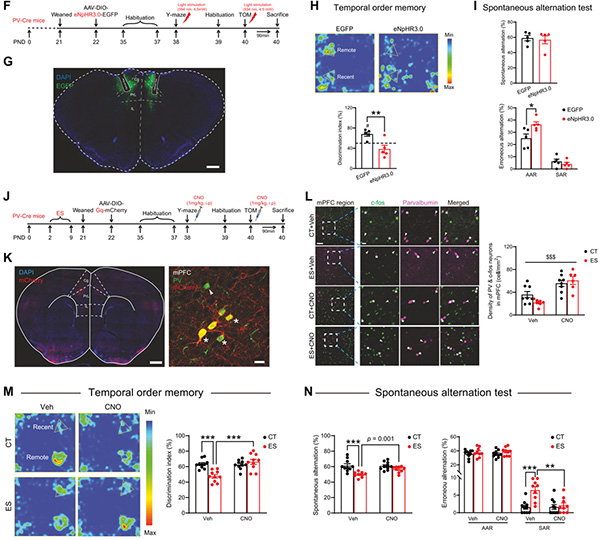
图3 前额叶PV中间神经元参与早年应激所致青春期雄鼠认知功能损伤
那么,PVIs的这一参与作用是否有其上游PN神经元的参与呢?研究者通过电生理检测,发现早年应激下调了mPFC的PN神经元兴奋性,而药物遗传学兴奋mPFC的PN神经元可以逆转早年应激所引起的认知损伤,结合前述实验发现,早年应激降低mPFC的PVIs的兴奋性输入。研究者推测早年应激可能首先通过抑制PFC PN功能活动,继而降低PVIs活性,导致青春期小鼠认知损伤。随后的双操控实验证实了研究者的推测(图4)。
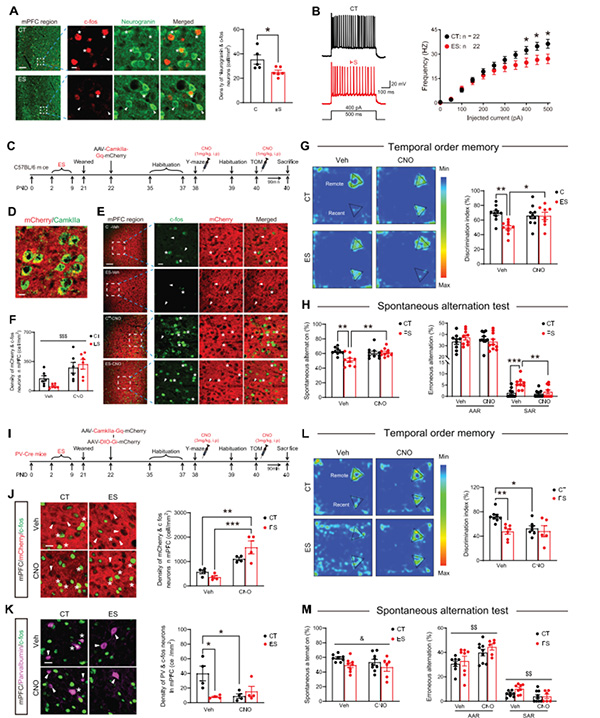
图4 前额叶锥体神经元参与调控早年应激引起青春期雄鼠认知功能损伤
最后,研究者通过遗传学、药理学等多种技术手段,证明早年应激通过上调CRH-CRHR1系统系统,继而下调PN活动,最终导致PVIs功能降低,诱发青春期小鼠认知损伤。早期给予CRHR1拮抗剂安他拉明可以通过修复PVIs功能活动,有效对抗早年应激所致认知损伤(图5)。
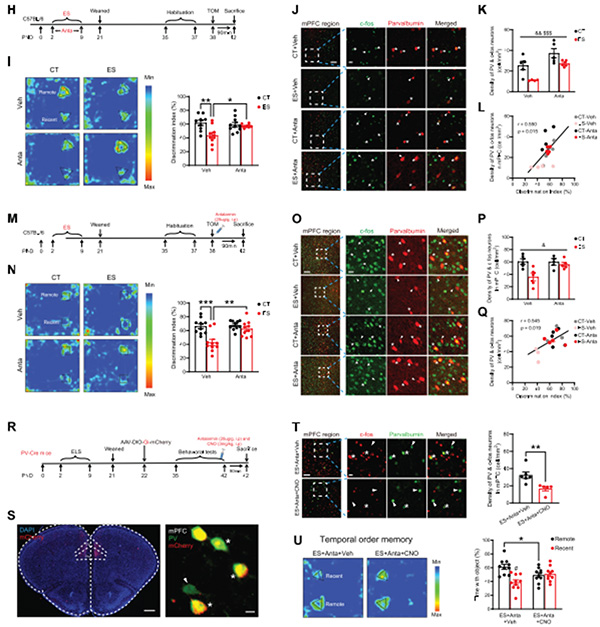
图5 CRHR1拮抗剂安他拉明通过恢复PV中间神经元活动对抗早年应激所致认知损伤
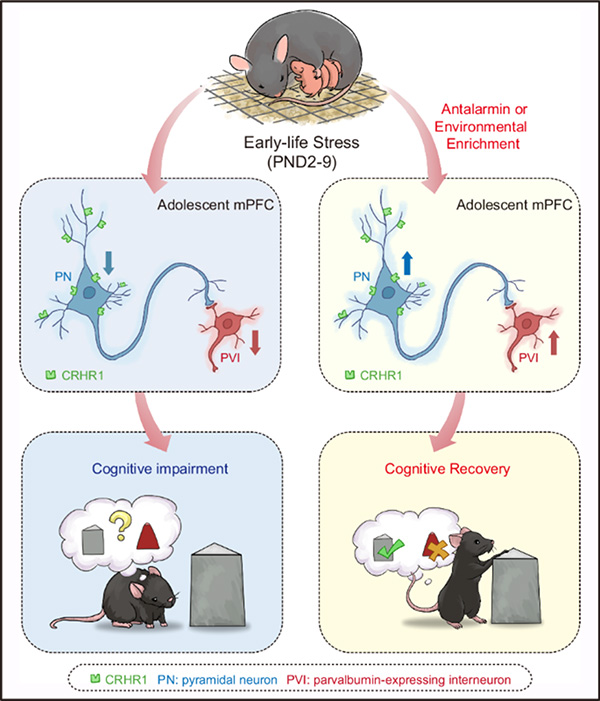
图6 文章总结图:前额叶 PVI 与 PN 和 CRHR1 共同介导青春期雄性小鼠早年应激诱发的认知功能损害
本研究明确了前额叶PVIs与PNs和CRHR1在早年应激所致青春期雄性小鼠认知损害中的作用,并提示研发具有修复前额叶PVIs功能活动的治疗策略,有望治疗青少年应激相关认知障碍。
然而,该研究也存在一定的局限性。例如,研究仅在雄性小鼠中进行,PVIs的这一参与作用是否也在雌鼠存在有待探讨。另外,研究PVIs与其他类型神经元在ES诱导认知缺陷中的相互作用网络,也将有助于更全面地揭示这一复杂的神经生物学过程,为开发针对ES相关精神疾病的干预策略提供更多的理论依据。
原文链接:https://doi.org/10.1038/s41380-024-02845-6

司天梅教授课题组合影
(司天梅教授--第一排左4;马玉努博士--第一排左1)
本文第一作者为北京大学第六医院博士生马玉努(现为北京生命科技研究院助理研究员)。北京大学第六医院的司天梅教授、李继涛副研究员和苏允爱研究员为通讯作者。感谢首都医科大学张晨教授及其团队、浙江大学王晓东教授为本工作提供重要支持。该项目得到了国家自然科学基金、北京市自然科学基金的资助。

通讯作者介绍:司天梅,教授,博士生导师。现任北京大学第六医院教学副院长。
更多实验室详情见:https://www.pkuh6.cn/Html/News/Articles/168.html
司天梅课题组欢迎具有神经科学、影像学、脑电生理、药理学、心理学、分子生物学背景的同学申请研究生。课题组亦诚聘不同学科背景的博士后,待遇从优。欢迎有意向的青年学者发送简历至suyunai@163.com。
招聘博士后链接:https://www.pkuh6.cn/Html/News/Articles/5394.html

 English
English
 院内办公OA登录
院内办公OA登录

 北京大学第六医院
北京大学第六医院 海淀院区:北京市海淀区花园北路51号
海淀院区:北京市海淀区花园北路51号






